產品搜索
聯系我們
電話:4008750250
手機:18066071954
地址:南京市棲霞區緯地路9號
Email: zhangxiangwen@cobioer.com
技術文章 / article
【分享】NIST開發ERBB2- CNV標準品的一些思路
原載自:www.diyiqukuai.com.cn[技術資料頻道] 2022-02-22 瀏覽次數:1294
一般來說,拷貝數變異CNV(copy number variant)被定義為人類基因組中1kb或更大的DNA的片段的擴增或減少,CNV可以分為拷貝數擴增(copy number gain)和拷貝數缺失(copy number loss),在腫瘤細胞中,往往會出現原癌基因的擴增,抑癌基因的缺失,擴增和缺失一般會直接影響RNA和蛋白的表達,進而影響腫瘤的發生、發展,與腫瘤細胞的生長、藥物敏感性、耐藥性都密切相關。有數據表明,CNV在人類癌癥基因組中普遍存在,比起單核苷酸多態性 (SNP) ,CNV影響更大的基因組片段。
基因CNV的檢測有多種方法,包括Southern印跡雜交、熒光原位雜交(FISH)、聚合酶鏈反應(PCR)、比較基因組雜交(CGH)、全基因組單核苷酸多態性 (SNP) 陣列和NGS等,各有優點和缺點。
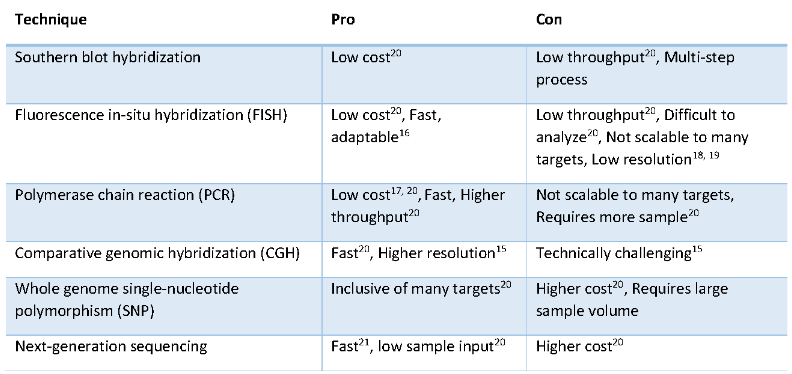
Fig 1. CNV檢測技術比較
今天我們與大家分享一篇NIST(National Institute of Standards and Technology)的文章(點擊即可查看文章內容),是他們開發2373標準物質的過程:針對HER2的gDNA標準品,主要是用于Q-PCR和dPCR的,當然也是適用于NGS,但是由于檢測方法不同、分析方法不同,在定值上會與Q-PCR和dPCR不一致。
首先文章發現很多乳腺癌患者的樣本存在大量的染色體結構異常,在開發Q-PCR和dPCR時,需要
選擇內參基因,內參基因的選擇要盡量避開染色體異常的區域。研究發現,這些乳腺癌樣本在1q, 8q, 20q, 7, 11q, 13, 17q, 9q ,16p等區域經常發生基因的擴增,在8p, 11q14-qter, 18q, Xq等區域經常發生基因的缺失,同時內參基因的選擇盡量不能在chr17(HER2基因的位置)上選擇,因此文章最終選擇了DCK基因、EIF5B基因、RPS27A基因和PMM1基因(其中PMM1僅用于Q-PCR實驗)。

Table 1. HER2和內參基因的引物信息
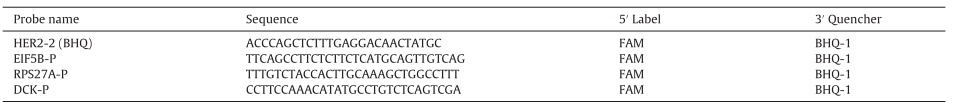
Table 2. HER2和內參基因的探針信息
作為一個標準品,需要盡量模擬臨床樣本,同時需要穩定的長久供應,因此文章選擇了5個常見的乳腺癌細胞作為標準品的原材料,用于定標實驗,分別為:SK-BR-3(components A), MDA-MB-231(components B), MDA-MB-361(components C), MDA-MB-453(components D)和 BT-474(components E),這些細胞經過培養,提取gDNA,STR鑒定,確保質量合格,備用于接下來的測試。
同時文章構建了一個HER2 cDNA的質粒,通過質粒的分子量,計算得到質量與拷貝數的對應關系,構建標準曲線,同時引入2372-A樣本(全基因組DNA: gDNA),也構建質量與拷貝數的關系,通過Q-PCR檢測,發現有很強的相關性,R2=0.9924,進而得到2372-A樣本在二倍體時,對應HER2的拷貝數為2,進而可以用于components A-E的檢測校準。
接下來對components A-E開展Q-PCR和dPCR的檢測,Q-PCR采用4種內參基因,根據校正標曲計算得到A-E樣本的copies/μL,dPCR采用3種內參基因,同時計算A-E樣本的copies/μL和與內參基因的比值,在這里,文章中使用了2種dPCR的方法,分別為
droplet dPCR和chamber dPCR。
在計算上,首先通過質粒HER2 cDNA的Q-PCR數據,校正2372-A的gDNA樣本,顯示2372-A樣本二倍體樣本,HER2拷貝為2,再利用2372-A樣本計算A-E樣本的拷貝數值(copies/μL),dPCR則直接檢測HER2和內參基因的拷貝數,進而計算比值。
最終文章顯示首先2種dPCR采用3種內參基因,計算HER2與內參基因的比值,結果有很強的
一致性,5個樣本出現不同程度的拷貝數擴增,有弱有強。
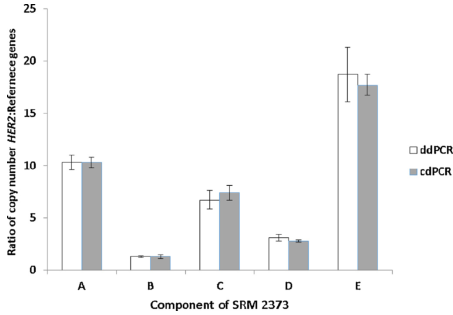
Fig 2. 針對A-E樣本,2種dPCR的方法一致性較好。(數據為3種內參的平均值)
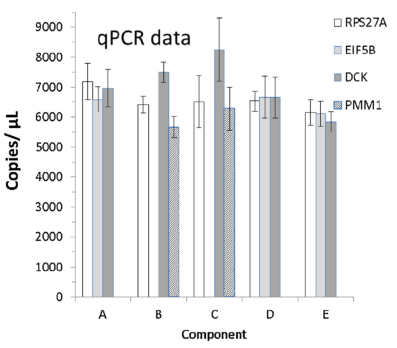
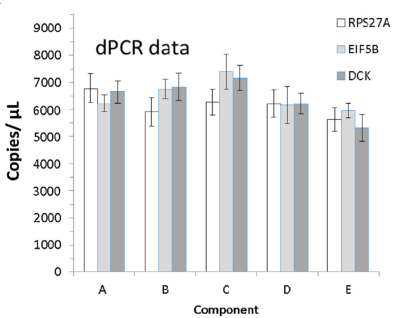
其次A-E樣本在Q-PCR和dPCR上針對copies/μL也有很強的一致性,表明A-E標準品同時適用于Q-PCR和dPCR應用。
|
|
Fig 3. 左側為A-E樣本在Q-PCR檢測中內參的拷貝數值,右側為A-E樣本在dPCR檢測中內參的拷貝數值。 | |
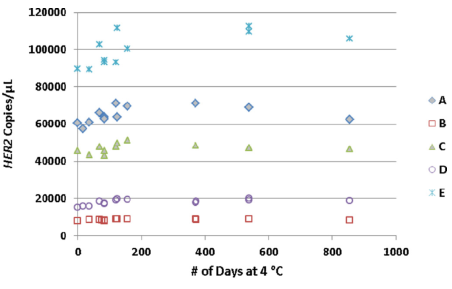
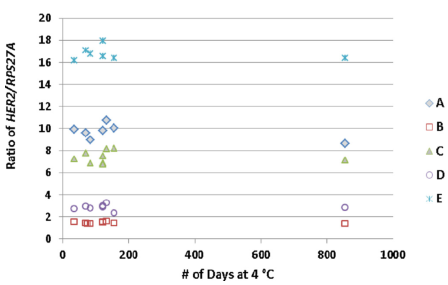
另外文章還檢測了A-E樣本的穩定性,在長達856天的測試中,不管是絕對的拷貝數,還是與內參的比值,都呈現良好的穩定性。
|
|
Fig 4. 不管是HER2的拷貝數值,還是與內參的比值,在856天的測試中,都較穩定。 | |
最后文章還測試了隨機因素對A-E實驗的重復性的影響,比如機器、操作者、日期等等,呈現良好的重復性。
綜上可知,在開發CNV檢測的分子診斷標準品時,我們需要注意:
● 可以設置絕對的拷貝數值(copies/μL)作為標準,可以使用dPCR和Q-PCR定標,其中Q-PCR需要使用校正標曲;
● 可以設置與內參基因的比值,作為標準,適合dPCR的方法(Q-PCR也可以,同樣需要校正標曲),這時需要注意內參的選擇原則,如果可以的話,盡量多選擇幾個內參基因;
● 標準品需要穩定供應,需要測試長久的穩定性,測試在不同的隨機因素下的重復性;
但是我們發現還是有一些問題沒有解決,比如:Q-PCR和dPCR都是很短序列的PCR反應,在整個HER2基因的什么
區段選擇擴增?不同區段的擴增效率會直接影響拷貝數值(copies/μL),進而不同區段檢測得到的拷貝數與內參基因的比值也會不一致,甚至是否會出現PCR反應正好設計在各個拷貝的差異處,就不僅僅是擴增效率的問題了。
另外在文章之外,我們可以
探討下:這個標準品是否適用于NGS?我們知道NGS是比較各處的測序深度,進而判斷區域的拷貝數,與Q-PCR和dPCR的檢測方法差異很大,看起來NGS會檢測到不一樣的結果。