產品搜索
聯系我們
電話:4008750250
手機:18066071954
地址:南京市棲霞區緯地路9號
Email: zhangxiangwen@cobioer.com
技術文章 / article
Nature:繞過Ras激酶“不可成藥性”的抗癌新思路
原載自:www.diyiqukuai.com.cn[技術資料頻道] 2016-09-20 瀏覽次數:1784
Ras-MAPK信號通路的失控發生于多種腫瘤的早期演進過程中,并且也是很多腫瘤抗藥性的內在原因。Ras-MAPK信號通路的持續性異常激活常由于K-Ras激酶的突變導致。然而,Ras激酶長期以來被認為是“不可成藥”蛋白,即便在體外實驗中起作用的藥物,一旦到了體內也常常會失效。這嚴重降低了Ras作為藥物靶點的潛力。
在Ras-MAPK信號通路中,K-Ras可穩定RAF信號傳導復合物,從而提高RAF激酶的活性。另一方面,假酶的一種——Ras激酶抑制蛋白(KSR)作為一種支架蛋白,通過結合RAF及其底物蛋白MEK激酶,也可穩定RAF信號傳導復合物,從而進一步活化Ras-MAPK信號通路。
不過KSR對于Ras-MAPK信號通路的作用不僅僅是激活。當K-Ras由于發生突變而異常活化時,如果KSR也發生突變,部分的KSR突變則會反過來抑制異常活化的突變K-Ras,具備了抑癌的潛力,而不會影響正常的K-Ras。因此,我們是否可能改變KSR的特性,即便在沒有發生突變的情況下,使其得以抑制突變的K-Ras,從而間接地為持續異常激活的Ras-MAPK信號通路“降溫”,達到抗癌的效果呢?
zui近,西奈山醫學院的科學家們就受此啟示,開發出了可改變正常KSR特性,使其能夠像上述KSR突變體那樣靶向抑制突變型K-Ras的小分子化合物。這一成果發表于zui近的《Nature》期刊上。
研究者發現,這些使得KSR具備抑癌能力的突變多發生于該蛋白上的ATP結合區域附近,并推測這些位點可能在KSR結合RAF與MEK激酶的過程中發揮重要角色。在此基礎上,他們發現了一類可與ATP競爭結合KSR,并改變其構象的小分子。這些小分子可使KSR傾向于結合MEK,而不再去結合RAF,進而使得KSR在體外細胞系實驗中表現出抑制突變K-Ras活性的能力。
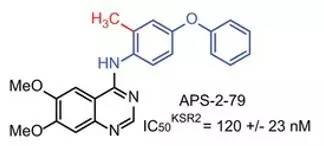
▲APS-2-79結構(圖片來源:《Nature》)
APS-2-79是上述小分子中的一個典型代表。結構分析顯示,它與KSR的結合可將后者固定在一個非活性的狀態,使其無法再結合RAF和激活MEK,從而阻遏了Ras-MAPK信號通路的活動。
體外實驗顯示,APS-2-79本身并不能抑制帶有KRAS突變的癌細胞,但是能夠加強MEK抑制劑藥物(包括已批準上市的trametinib)對上述細胞的殺傷效果。這顯示出APS-2-79與多種Ras-MAPK通路抑制劑聯合使用以治療癌癥的潛力。

▲文章通訊作者Arvin C. Dar教授
“KSR屬于一個相當大的蛋白質家族,不僅與癌變有關,還涉及到其他很多疾病的發生,”文章通訊作者Arvin C. Dar教授表示:“目前還沒有人想到怎樣才能充分挖掘這類重要治療靶點的潛力。我們的研究揭示了調節KSR活性作為一整套全新癌癥療法的可能性。”



